海水中具有的各种可溶性物质相互作用,然后达成一个平衡,使酸碱度PH能够维持在一个相对稳定的阶段、。向海水系统中加入一些酸性物质和碱性物质,会引起PH的微小变化,经过缓冲作用后,又回到原来的水平,在一个生态系统中生物的代谢活动也参与其中,使这个平衡过程变的相当复杂。海水的PH一般为8.1—8.4之间,适合的范围为7.6—8.5之间。而影响PH的因素在我们的海水缸中莫过于CO2,而生物活动又会都会放出CO2,植物的光合作用又会吸收CO2,其过程如下
6 CO2 +6 H2O—6C6H12O6 +6O2
;在水中CO2 主要以3种形式存在:
1.游离的CO2 ;
2.HCO3— ;
3.CO32— 。
这三种形式都为相互依赖,独自变化,共同构成二氧化碳的平衡系统。
二氧化碳的平衡系统
以上三种形式存在5类平衡过程
1.气态CO2 溶解过程:CO2(气体)—CO2(溶液)
2.溶解CO2 的水合作用,生成H2CO3 H2O+ CO2 = H2CO3
3.H2CO3 的电离平衡:H2CO3 = HCO3— +H+ HCO3— = CO32 +H+
4.中和与水解平衡:HCO3— + H+ = CO2 + H2O
CO32— +2 H+ = CO2 + H2O
HCO3— +OH—= CO32— + H2O
5.与碳酸盐沉淀之间的固液平衡:CO32— +Ca2+ =CaCO3
这五个平衡是相互联系的,相互制约,只有通过上诉五个过程的平衡条件同时得到相互满足,二氧化碳的系统平衡才能真正的建立。通常水中CO32— 和CO32— 的浓度之和称为碳酸盐硬度(KH),Ca2+ 与Mg2+ 的浓度之和成为钙镁硬度。
任何条件的变化将使平衡向某一方向移动,可以引起以下变化:
1.气体CO2 的溶解或逃逸;
2.Ca2+,Mg2+ 等金属离子与CO32— 形成碳酸盐的沉淀或溶解;
3.PH的变化
4.CO2、HCO3—、CO32— 相互转化,从而影响水的碳酸盐(KH)硬度和钙镁硬度;
5.缓冲性的改变;
6.有效碳的变化等。
PH对二氧化碳平衡系统的影响
在海水中,PH、CO2、碳酸盐(KH)硬度三者之间的确有着非常密切的关系。水中CO2
、HCO3—、CO32— 的比例主要取决于PH,它们之间的变化分为五种情况:
PH4的时候,只有CO2
PH12时候,只有CO32—
而PH4.0—8.3之间时,CO2和HCO3—共存
PH8.3—12是,HCO3—和CO32—共存
PH8.3时,只有存在HCO3—
所以PH是移动平衡系统的重要手段。反言之,改变水中的CO2、HCO3—、CO32— 的浓度,可以推动平衡向某一个方向发展,也可以改变水中的PH。
PH随着CO2(mg/L)和碳酸盐硬度(KH)的变化参考:
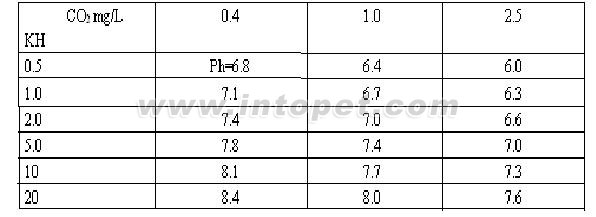
水族箱中PH和碳酸盐硬度的变化
天然海水中PH保持在7.6—8.4之间,碳酸盐硬度KH值保持在7—9odH。在我们的水族缸中,维持一个水平很不容易。事实上在这个生态系统中,生命在继续,CO2 在不断地被释放、被消耗、这个平衡一直在某一个范围内浮动着。动、植物的呼吸会放出大量的CO2,细菌分解工作下也会放出CO2,藻类的生长,消耗CO2,甚至我们为了充氧而打气,无意中也会使水中溶解的CO2 逸出,这些都导致CO2 的不平衡。
